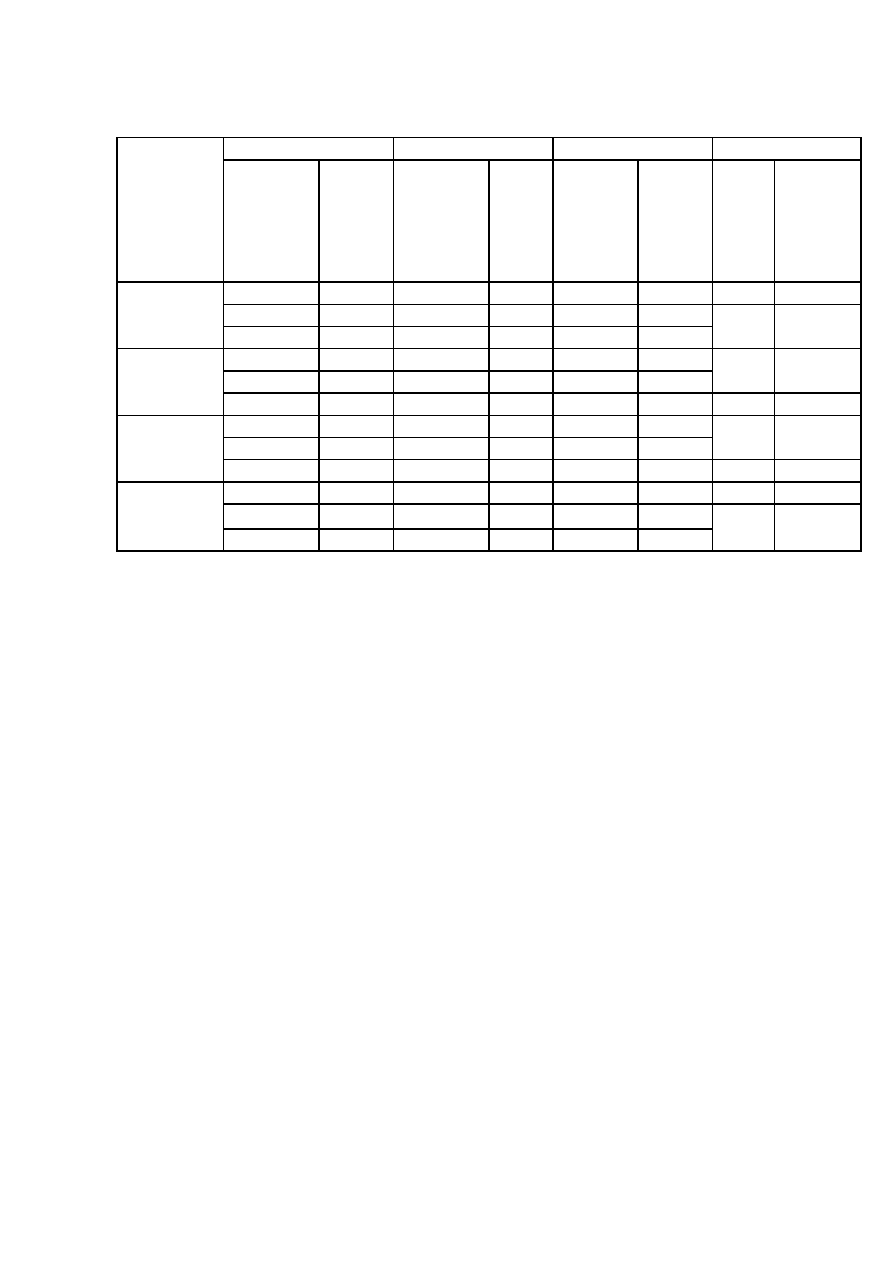
Таблица 4 – Изучение безопасности штаммов бактерий
E. coli
№ штамма
Безвредность
Вирулентность
Токсичность
Токсигенность
Вводимая
доза живых
E.coli,
х10
10
КОЕ/
0,5 мл
Кол-во
живых/
павших
мышей
Вводимая
доза живых
E.coli,
х10
9
КОЕ/
0,5 мл
Кол-во
живых/
пав-
ших
мышей
Вводимая
доза
инактиви-
рованных
E. coli,
х10
9
КОЕ/мл
Кол-во
живых/
павших
мышей
Вводи
мая
доза,
мл
Кол-во
живых/
павших
мышей
E. coli
M-17
1
10/0
0,1
10/0
0,1
10/0
0,1
10/0
5
10/0
0,5
5/5
0,5
5/5
0,5
10/0
10
10/0
1
10/0
1
10/0
E. coli
Г-35-1/59
1
10/0
0,1
10/0
0,1
10/0
0,1
10/0
5
10/0
0,5
5/5
0,5
5/5
10
10/0
1
10/0
1
10/0
0,5
10/0
E. coli
Г-35-1/60
1
10/0
0,1
10/0
0,1
10/0
0,1
10/0
5
10/0
0,5
5/5
0,5
5/5
10
10/0
1
10/0
1
10/0
0,5
10/0
E. coli
Г-35-1/51
1
10/0
0,1
10/0
0,1
10/0
0,1
10/0
5
10/0
0,5
5/5
0,5
5/5
0,5
10/0
10
10/0
1
10/0
1
10/0
ПРОИЗВОДСТВО
Производство
колисодержащих
пробиотиков
основано
на
выращивании/культивировании производственного штамма бактерий
E. coli
на
оптимальной питательной среде в соответствующих условиях методом
глубинного культивирования с последующей лиофилизацией биомассы в
защитной среде.
При производстве колисодержащих пробиотиков проводят валидацию
технологического процесса и методов контроля, которые в соответствии с
требованиями правил организации производства и контроля качества ИЛП
доказывают, что производственный процесс, оборудование, исходное сырье,
деятельность персонала, конкретная методика действительно приводят к
ожидаемым результатам и гарантируют, что лекарственное средство
изготовлено в соответствии со своим составом, не содержит контаминантов и
бактериофагов, маркировано надлежащим образом, упаковано и сохраняет свои
свойства в течение всего срока годности.
Предыдущая < | 2559 | > Следующая | Главная | pharma-14@mail.ru | pharmacopeia.ru | Скачать в PDF