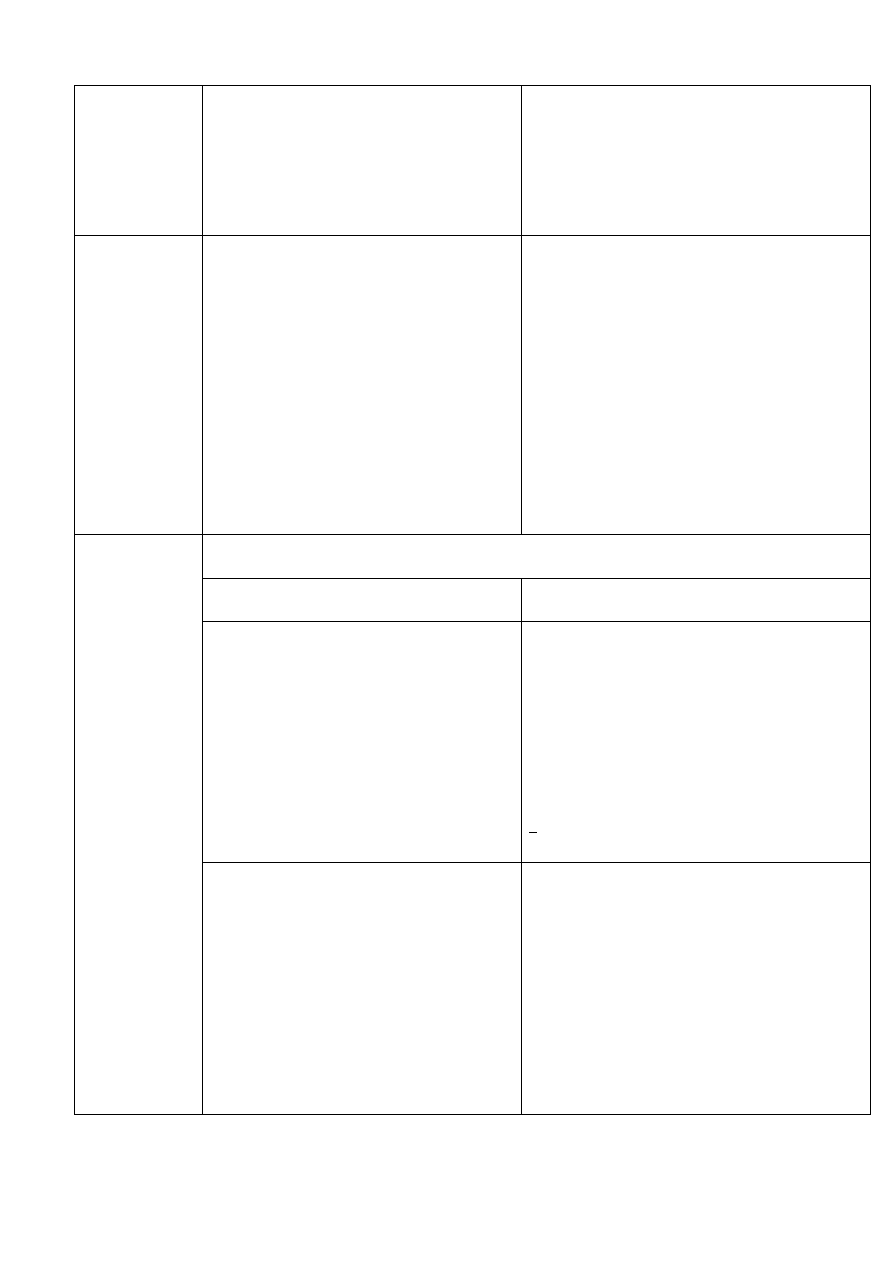
25 г (мл)
•
Отсутствие
Pseudomonas aeruginosa
в
1 г (мл)
•
Отсутствие
Staphylococcus aureus
в 1
г (мл)
•
Энтеробактерий, устойчивых к желчи,
- не более 10
2
КОЕ
в 1 г (мл)
4.2
Вспомогательные вещества (мука
пшеничная, крахмал, тальк и т.д.)
•
Общее число аэробных
микроорганизмов - не более 10
3
КОЕ в 1
г (мл)
•
Общее число дрожжевых и плесневых
грибов – не более 10
2
КОЕ в 1 г (мл)
•
Отсутствие
Escherichia coli
в 1г (мл)
•
Отсутствие бактерий рода
Salmonella
в 25 г (мл)
•
Отсутствие
Pseudomonas aeruginosa
в
1 г (мл)
•
Отсутствие
Staphylococcus aureus
в 1
г (мл)
•
Энтеробактерий, устойчивых к желчи,
- не более 10
2
КОЕ
в 1 г (мл)
5.2
Субстанции для производства биологических лекарственных препаратов
(БЛП):
А. Стерильных БЛП, которые не
подвергаются стерилизации
Субстанции должны быть
стерильными
Б.
−
Стерильных лекарственных
препаратов, которые подвергаются
стерилизации в упаковке;
−
Стерильных лекарственных
препаратов, при
производстве/изготовлении которых
для обеспечения стерильности
используется стерилизующая
фильтрация
•
Общее
число
аэробных
микроорганизмов – не более 10
2
КОЕ в 1
г (мл)
•
Общее число дрожжевых и плесневых
грибов - менее 10 КОЕ в 1 г (мл)
•
Отсутствие энтеробактерий, устойчивых
к желчи в 1 г (мл)
•
Отсутствие
Pseudomonas aeruginosa
в 1
г (мл)
•
Отсутствие
Staphylococcus aureus
в 1
г (мл)
В. Субстанции для производства БЛП,
содержащие живые микроорганизмы:
−
в
которых
не
допускаются
микроорганизмы-контаминанты
(живые вакцины (инъекционные
препараты),
бактериофаги,
растворы для приема внутрь и
ректально);
−
в
которых
лимитируются
микроорганизмы-контаминанты
(живые вакцины для приема
внутрь, бактериофаги)
Не допускается присутствие
микроорганизмов-контаминантов
определение проводят в соответствии с
ОФС «Стерильность», ОФС «Вакцины и
анатоксины» и ФС или нормативной
документацией)
Предыдущая < | 1134 | > Следующая | Главная | pharma-14@mail.ru | pharmacopeia.ru | Скачать в PDF