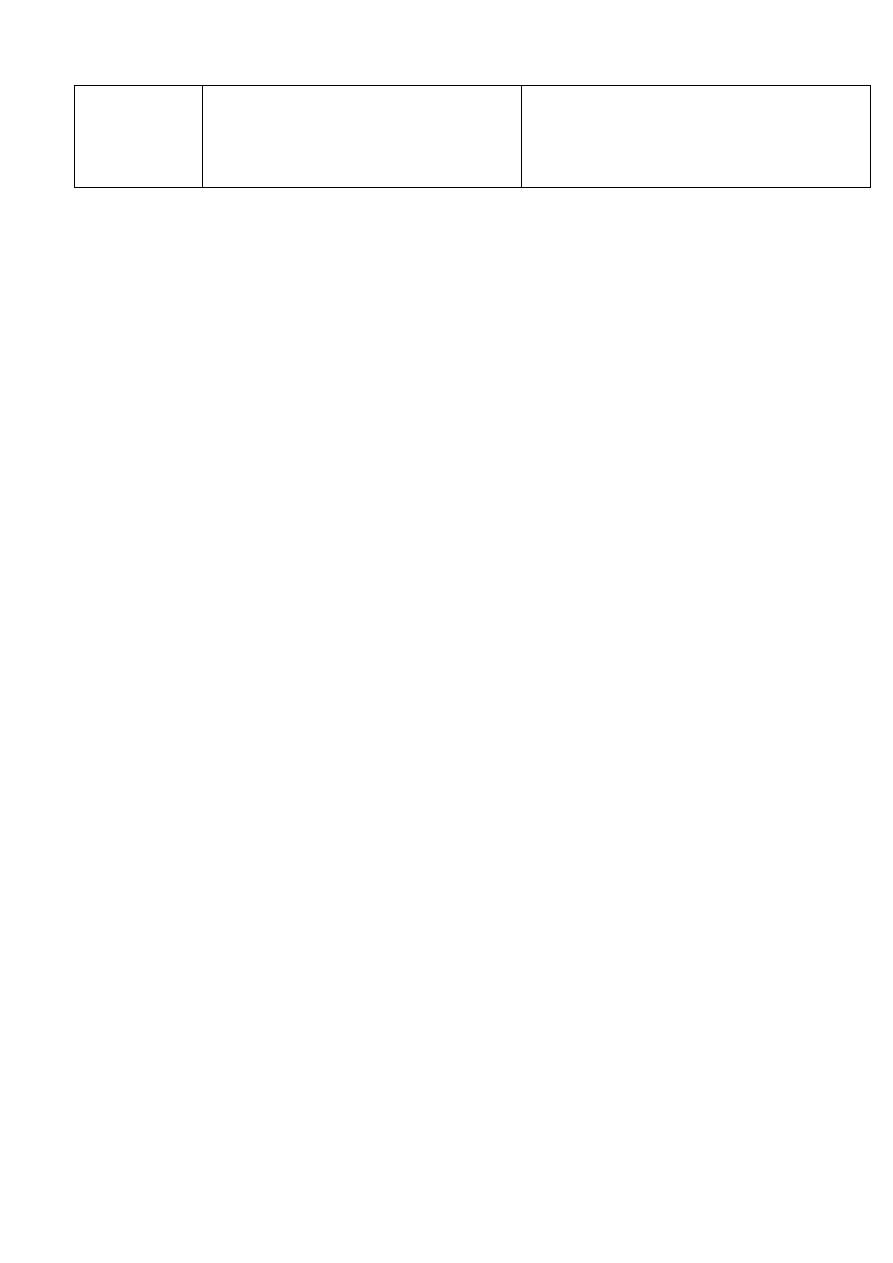
Г. Для производства пробиотиков, в
которых
допускаются
микроорганизмы-контаминанты
(таблетки, капсулы, суппозитории)
•
Отсутствие посторонних аэробных
бактерий в 1 г
•
Отсутствие дрожжевых и плесневых
грибов в 1 г
Примечания к Таблицам 1 и 2
1.
В нормативных документах могут быть указаны в виде исключения и
другие нормы в зависимости от состава ЛС и особенностей технологического
процесса их производства.
2.
В нормативных документах на препараты для детей могут быть введены
более строгие нормы, а именно:
- в 1 г (мл) препаратов для детей (от 0 до 1 года) - не более 50 аэробных
бактерий и дрожжевых и плесневых грибов (суммарно) (для БЛП – «Общее
количество аэробных микроорганизмов - не более 50 КОЕ в 1 г (мл); общее
число дрожжевых и плесневых грибов – менее 10 КОЕ в 1 г (мл)»), при
отсутствии энтеробактерий, устойчивых к желчи
, Pseudomonas aeruginosa,
Staphylococcus aureus;
- в 1 г (мл) препаратов для детей (старше 1 года) - не более 500 аэробных
микроорганизмов и 50
дрожжевых и плесневых грибов при отсутствии
энтеробактерий, устойчивых к желчи,
Pseudomonas aeruginosa
,
Staphylococcus aureus.
3.
В нормативных документах на БЛП
−
пробиотики для детей должны
быть введены более строгие нормы, а именно:
- для детей (от 3 месяцев до 1 года) для приема внутрь (таблетки, капсулы и
др.), ректально (суппозитории) - не более 10 аэробных бактерий-
контаминантов в 1 единице препарата/г; при отсутствии в 1 единице
препарата бактерий семейства
Enterobacteriaceae
,
Pseudomonas aeruginosa,
бактерии рода
Proteus, Staphylococcus aureus
и дрожжевых и плесневых
грибов;
- для детей (от 1 года) для приема внутрь (таблетки, капсулы), ректально
(суппозитории) - не более 50 аэробных бактерий-контаминантов в 1 г
препарата; при отсутствии в 1 единице препарата бактерий семейства
Enterobacteriaceae
,
Pseudomonas aeruginosa,
бактерии рода
Proteus,
Staphylococcus aureus,
дрожжевых и плесневых грибов
.
4. При обнаружении во время проведения испытания других патогенных
микроорганизмов, кроме указанных выше, считают, что качество
лекарственных средств, субстанций и вспомогательных веществ не
соответствует требованиям по показателю «Микробиологическая чистота».
5. К категориям 1.2.Б и 5.2.Б могут быть отнесены термолабильные
субстанции, которые используются в производстве стерильных
лекарственных препаратов, не подвергающихся стерилизации в
окончательной упаковке. Такие субстанции не могут быть подвержены
Предыдущая < | 1135 | > Следующая | Главная | pharma-14@mail.ru | pharmacopeia.ru | Скачать в PDF